热点 来源: 时间:2025-05-28 10:21:30
在狂犬病疫苗的评选中,细胞基质已成为衡量疫苗质量的关键标准之一。当前,Vero细胞与人二倍体细胞的优劣之争成为行业焦点。卓谊生物通过对 Vero细胞基质的深度开发,以科学数据和生产实践,在疫苗质量稳定控制与安全性方面取得了显著成果。
回望人用狂犬病疫苗的发展历程,细胞基质的演变清晰地记录了技术进步的轨迹。从我国行业常用的细胞基质来看,其发展可划分为三代。第一代是 1968 年批准使用的地鼠肾细胞,由于其效价低、免疫效果差、生产过程难以控制,已被逐步淘汰。第二代为 1974 年批准使用的二倍体细胞,虽然理论安全性较高,但产量低、价格昂贵,且超过一定代次后细胞会衰老,存在染色体异常风险。第三代则是 1985 年批准使用的 Vero 细胞,它具有良好的免疫原性和安全性,适用于微载体生物反应器的大规模生产,稳定性高,工艺成熟,因此得到 WHO 的推荐使用[1]。
在细胞基质的 “代际之争” 中,安全性是至关重要的考量因素。人二倍体细胞疫苗因价格高昂,容易误导大众的判断,然而价格高并不一定代表质量好。随着全球狂犬病防控需求的不断增长,人二倍体细胞的局限性逐渐显现,如传代寿命短、大规模培养难度大、对培养液及牛血清营养成分依赖度高,导致生产成本居高不下,难以满足我国的刚性需求。而 Vero 细胞凭借其可大规模培养、工艺成熟、稳定性好等优势,逐渐成为国际主流选择。不过,业内人士对 Vero 细胞存在一些质疑,主要聚焦于高代次细胞是否具有致瘤风险以及能否匹配中国本土流行毒株这两个关键问题。
卓谊生物采用 “低代次Vero细胞+CTN-1毒株” 的技术组合,成功解决了这两大难题。在生产狂犬病疫苗时,卓谊生物所使用的 Vero 细胞终末代次被严格控制在 140 代以内,远低于 WHO 推荐的 150 代安全阈值。多项研究已经证实,150 代以内的 Vero 细胞无致瘤风险,而卓谊生物通过工艺优化,进一步将代次压缩至 140 代,从源头上消除了潜在风险。值得关注的是,其采用的 Vero 细胞经过中国药品生物制品检定所的权威验证,确认无致瘤性风险,即无肿瘤生长风险。
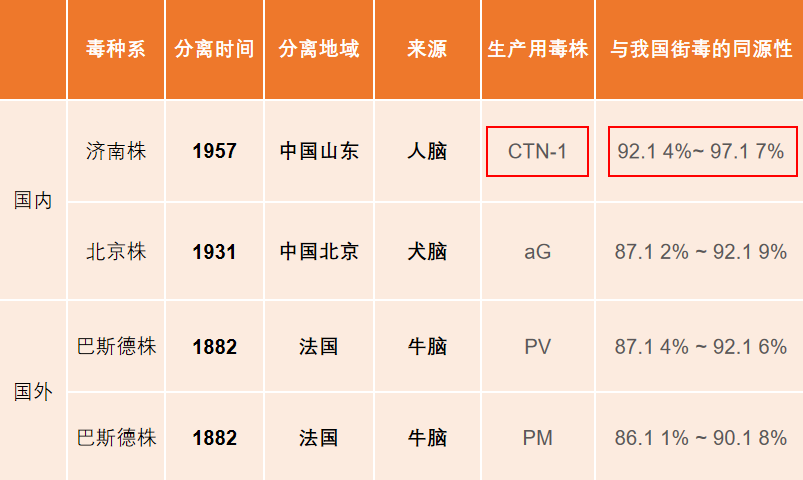
此外,毒株的选择对疫苗的保护效率起着决定性作用。卓谊生物使用的 CTN - 1 毒株取自中国山东患者人脑,是全新一代唯一的人源狂犬病疫苗毒株,与国内流行毒株的同源性最高。因此,接种后抗体的针对性更强,对病毒的中和效率更高,保护效果更显著[2]。
在狂犬病疫苗的技术领域,不存在绝对的 “最优解”,只有针对实际需求的 “更优解”。卓谊生物对 Vero 细胞基质的应用表明,通过精准的代次管理、严格的质量控制和扎实的临床验证,能够将风险有效控制在安全阈值内。鉴于 WHO 明确认证 “150 代以内 Vero 细胞无致瘤风险”,以及全球多种 Vero 细胞疫苗(如脊灰、新冠等)的实际接种积累了真实的安全数据,我们应当摒弃 “疫苗细胞偏见” 的固有思维,回归技术本质。无论是二倍体细胞还是 Vero 细胞,其核心价值在于能否通过科学手段实现 “质量稳定、安全可控、广泛可及”。
卓谊生物的实践为行业提供了一个极具参考价值的范例。在保障安全与效果的前提下,借助技术创新使优质疫苗能够惠及更广泛的人群,这正是细胞基质技术发展的真正意义所在。尤其在狂犬病这种致死率为 100% 的严重疾病面前,我们需要的不仅是实验室里的 “完美” 理论,更需要临床上的 “可靠” 性能以及产业链上的 “可行” 方案,而卓谊生物在低代次 Vero 细胞的应用上,为狂犬病疫苗的研发与生产开辟了新的路径。
[1] 疫苗生产用细胞基质的技术审评一般原则,药物审评中心,2005 年 12 月
[2] 石磊泰,俞永新*,刘景华,等. 中国狂犬病疫苗生产株 CTN -1 全基因序列分析[ J]. 中国病毒学报,2010,26( 3):195 - 200